秋风渐紧,小伙伴们是不是一边捧着秋日第n杯奶茶,一边烦恼着如何减重呢?
全天下有近五分之一的人受到肥胖问题的困扰。除了边幅及身材焦虑,肥胖也带来一系列康健威胁,包括糖尿病、脂质代谢非常、非酒精性脂肪肝及高血压等心脏代谢综合征(CMS)[1]。面对这一环球性盛行病,科学家们不断探索促进脂肪分解、掌握体重的有效方法。

近日,由约翰霍普金斯大学医学院David A. Kass教授领衔的研究团队在《临床调查杂志》 揭橥主要研究结果,他们的研究创造:“伟哥”的近亲cGMP磷酸二酯酶PDE-9A选择性抑制剂(PDE9-I)可促进脂肪细胞线粒体代谢及脂肪分解,从而治疗饮食勾引的肥胖及心脏代谢综合征(CMS)[2]。
他们的研究表明:老药PDE9-I在治疗心力衰竭之外,对中央性肥胖及其干系的心脏代谢综合征具有潜在治疗浸染。
David A. Kass教授团队揭示PDE9-I的减脂浸染
由利钠肽(NP)或一氧化氮(NO)激活的cGMP-PKG通路是内源性脂肪分解的主要路子之一。
既往研究表明,激活cGMP-PKG通路可通过上调激素敏感性脂肪酶(HSL)及周脂素(perilipin)表达水平,促进线粒体氧化代谢及胰岛素通路活性,从而抑制饮食勾引的肥胖 [3]。据此,促进cGMP合成或抑制cGMP水解,可能是促进脂肪分解进而减重的有效治疗手段。
然而,人工合成的重组利钠肽、(亚)硝酸盐等可溶性cGMP激动剂有着半衰期短、潜在降血压浸染等局限性 [4]。那么,从抑制cGMP水解的角度入手,能否实现我们的减脂目标呢?
PDE5、PDE9是经典的特异性降解cGMP的磷酸二酯酶。
个中,PDE5抑制剂(PDE5-I)可通过激活NO-cGMP通路扩展血管,而被用于治疗勃起功能障碍、肺动脉高压及心力衰竭等疾病[5]。遗憾的是,在仿照绝经期妇女生理条件的卵巢切除小鼠模型中,科学家们创造PDE5-I的心血管保护浸染竟不复存在[6]。
众所周知,中央性肥胖及心脏代谢综合征在绝经后妇女中发生率远远高于绝经前的中青年女性 [7];而PDE5-I的心血管保护浸染显然无法覆盖到这一高危人群。
不同于PDE5-I,既往研究证明PDE9-I是通过激活NP-cGMP通路(而非NO-cGMP)发挥心血管保护浸染[5]。David团队猜想,不同的治疗机制可能使得PDE9-I对绝经妇女肥胖干系心血管病变有治疗浸染。
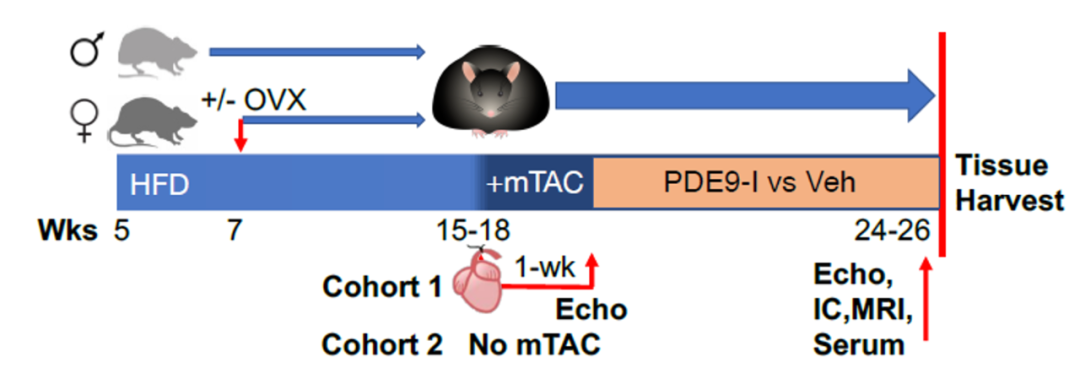
为探究PDE9-I对肥胖及心脏代谢综合征的治疗浸染,David A. Kass教授团队首先建立了合并心血管病变的饮食勾引肥胖模型(DIO/mTAC)。对雄性、雌性及手术切除卵巢(OVX)的雌性实验小鼠分别进行连续6个月高脂饮食(HFD)喂养。
个中一组小鼠在高脂饮食的后两个月被履行了主动脉夹闭(mTAC)手术,以造成轻度心脏压力负荷,作为合并有心脏代谢综合征的肥胖模型;其余一组则仅作高脂饮食处理勾引肥胖模型。
合并心血管病变的饮食勾引肥胖模型
随后,研究职员不雅观察口服PDE9-I对上述两种模型小鼠的治疗浸染。
他们创造,PDE9-I不仅可以明显减轻肥胖小鼠的体重及内脏脂肪含量,并且显著改进高血糖、高血脂、脂肪肝等代谢综合征的表现。
基于既往研究宣布的PDE9-I心血管保护浸染 [5],David团队进一步探究PDF9-I能否改进合并有心脏代谢综合征的肥胖小鼠心脏构造及功能非常。
结果创造,PDE9-I不仅显著改进DIO/mTAC小鼠左心室射血分数、等容迟豫韶光(IVRT)等心功能指标,并且下调一系列促进心肌肥大及纤维化的基因表达,有效掌握了心肌肥大进展。
值得把稳的是,PDE9-I的减脂及心脏保护用在雄性及手术切除卵巢(OVX)的雌性小鼠中较为同等,但对肥胖的雌性小鼠则无显著疗效。
PDE9-I改进心功能非常并抑制心肌肥大
那么,PDE9-I是如何发挥减脂减重、保护心脏的治疗浸染的呢?
David团队通过转录组测序创造,PDE9-I治疗组比较于对照组小鼠心肌细胞高表达转录因子PPARα。不仅如此,PPARα调控的多个下贱脂肪酸氧化(FAO)基因表达水平在接管PDE9-I治疗后也明显上调。
考虑到脂肪酸氧化是脂肪分解的主要路子之一 [1]。David团队想知道PDE9-I上调PPARα下贱脂肪酸氧化干系基因表达,是否促进了脂肪分解。
David团队在心肌细胞体外培养体系中,加入脂肪酸仿照高脂饮食对心肌细胞的毒性浸染。他们创造,PDE9-I处理的心肌细胞中脂滴沉积明显减少,并伴随线粒体数目增多、脂肪分解产物甘油水平上升。这些实验结果解释,PDE9-I可能通过促进线粒体脂肪酸氧化,减轻高脂对心肌细胞的毒性浸染。
PDE9-I促进心肌细胞分解脂肪
随后,David团队创造,利用PPARα小分子抑制剂(GW6471)抑制PPARα活性,将阻断PDE9-I对肥胖小鼠的减脂浸染。这一结果再次确证了激活PPARα,是PDE9-I促进脂肪分解的核心机制。
但还有一个没办理的问题是,为什么PDE9-I在高脂喂养的雌性小鼠中并没有明显的减脂疗效呢?
既往研究也有类似的创造,即内源性雌激素会抑制PPARα 活性并降落其下贱脂肪酸氧化干系基因表达水平,但个中机制如何仍未阐明 [8]。
David团队创造:在高脂喂养的雌性小鼠中,虽然PDE9-I处理依然上调PPARα的表达水平,但其下贱调控的脂肪酸氧化干系基因表达却无明显变革。
他们猜想,这可能是雌激素受体(ER)通路阻碍了转录因子PPARα与其下贱调控基因的结合浸染。
为了证明这一猜想,David团队通过染色质免疫沉淀-测序(ChIP-seq)实验创造:在仅加入PPARα激动剂的条件下,约有17500个DNA结合位点受到转录因子PPARα的调控浸染;而在同时激活了雌激素受体ERα条件下,这一数字险些减半;在共激活雌激素受体ERβ时,上述DNA结合位点中仅余1/3旁边仍受到PPARα调控浸染。
不仅如此,KEGG基因富集剖析显示:激活雌激素受体所抑制的PPARα靶基因大多数与细胞代谢干系,尤其是脂肪酸氧化代谢。这解释雌激素受体通路确实抑制了转录因子PPARα对脂肪酸氧化干系基因的调控浸染;也进一步阐明了为什么PDE9-I并不能有效促进肥胖雌性小鼠的脂肪分解及氧化代谢。
在肥胖雌性小鼠中,PDE9-I对PPARα脂肪酸氧化基因表达并无明显调节浸染
总的来说,David A. Kass教授团队的研究阐明了 PDE9-I这一血管扩展药可通过激活转录因子PPARα促进脂肪氧化代谢,进而治疗肥胖干系的心脏代谢综合征。
值得把稳的是,PDE9-I对未绝经中青年女性的减脂浸染可能并不理想。究其缘故原由David团队指出,雌激素受体通路抑制了PPARα对脂肪酸氧化干系基因的调控浸染,以至造成了PDE9-I减脂浸染的性别差异(猪猪girl狂风哭泣一秒…)。
减脂大业任重道远,期待科学家们研发奶茶小仙女们也能用的减肥新药!
参考文献:
[1] Koliaki C, Liatis S, Kokkinos A. Obesity and cardiovascular disease: revisiting an old relationship. Metabolism. 2019;92:98-107. doi:10.1016/j.metabol.2018.10.011
[2] Mishra S, Sadagopan N, Dunkerly-Eyring B, et al. Inhibition of phosphodiesterase type 9 reduces obesity and cardiometabolic syndrome in mice [published online ahead of print, 2021 Oct 7]. J Clin Invest. 2021;e148798. doi:10.1172/JCI148798
[3] Collins S. A heart-adipose tissue connection in the regulation of energy metabolism. Nat Rev Endocrinol. 2014;10(3):157-163. doi:10.1038/nrendo.2013.234
[4] Hoffmann LS, Etzrodt J, Willkomm L, et al. Stimulation of soluble guanylyl cyclase protects against obesity by recruiting brown adipose tissue. Nat Commun. 2015;6:7235. Published 2015 May 26. doi:10.1038/ncomms8235
[5] Lee DI, Zhu G, Sasaki T, et al. Phosphodiesterase 9A controls nitric-oxide-independent cGMP and hypertrophic heart disease. Nature. 2015;519(7544):472-476. doi:10.1038/nature14332
[6] Sasaki H, Nagayama T, Blanton RM, et al. PDE5 inhibitor efficacy is estrogen dependent in female heart disease. J Clin Invest. 2014;124(6):2464-2471. doi:10.1172/JCI70731
[7] Obokata M, Reddy YNV, Pislaru SV, Melenovsky V, Borlaug BA. Evidence Supporting the Existence of a Distinct Obese Phenotype of Heart Failure With Preserved Ejection Fraction. Circulation. 2017;136(1):6-19. doi:10.1161/CIRCULATIONAHA.116.026807
[8] Jeong S, Yoon M. Inhibition of the actions of peroxisome proliferator-activated receptor alpha on obesity by estrogen. Obesity (Silver Spring). 2007;15(6):1430-1440. doi:10.1038/oby.2007.171
本文作者丨BioTalker
















