文章来源:中华肝胆外科杂志, 2023, 29(9)
摘 要

非手术治疗在肝细胞癌治疗中霸占主要地位。治疗效果的准确评估对肝细胞癌非手术治疗方案的确定有着重要代价。随着治疗方法、理念的进步,肝细胞癌非手术治疗疗效评价标准不断更新和发展。本文总结了肝细胞癌非手术治疗疗效评价标准的发展过程,以及临床紧张运用的评价标准,以期为患者得到及时、有效的评估和治疗供应依据,并对未来评价标准的发展做出展望。
一、天下卫生组织(World Health Organization, WHO)标准
1979年WHO为标准化评价肿瘤治疗效果,制订出实体瘤丈量及疗效评价标准即WHO标准。该标准采取的肿瘤丈量方法称为双径法,即以肿瘤最大径与其最大垂直径的乘积代表肿瘤面积。同时,将病灶分为可丈量病灶与不可丈量病灶,可丈量病灶包括临床或影像学可丈量的皮肤结节、浅表淋巴结和转移性肺结节等;活检证明长径>5 cm的恶性肝结节也可作为可丈量病灶。无法用双径法丈量的病灶被定义为不可丈量病灶,如盆腔和腹部肿块,肺的癌性淋巴管炎或多结节领悟性肺转移灶等。并提出将治疗效果分为完备缓解、部分缓解、无变革和疾病进展[3]。见表1。WHO标准是为实现肿瘤疗效评价标准化做出的初步探索,但其对肿瘤病灶的定义缺少可量化指标,在运用中易受临床医师的主不雅观影响产生不同结果。当病灶边缘不规则时,双径法明显增加了人为偏差涌现的概率[4]。基于此,新的肿瘤非手术疗效评价标准不断被推出并更新。
二、实体瘤临床疗效评价标准(response evaluation criteria in solid tumor, RECIST)
1999年欧洲癌症治疗研究组织、美国国家癌症研究所等在WHO标准根本上提出RECIST[5]。该标准用单径丈量法取代双径法,以肿瘤最大径的变革反响肿瘤体积的改变。RECIST一方面指出应在治疗前4周内丈量并记录目标病灶(长径≥20 mm或螺旋CT≥10 mm的可丈量病灶,每个脏器最多5个病灶,病灶总数最多10个),称为基线的全部肿瘤负荷,并以此为根本与非手术治疗后的肿瘤负荷比较。别的病灶为非目标病灶,无需丈量,但应在治疗期间不雅观察其状态。另一方面,RECIST增长了关于肿瘤标志物的描述,认为肿瘤标志物不能单独用于疗效判断,但是若治疗前肿瘤标志物高于正常水平,临床评价完备缓解时,所有标志物需规复正常[5,6]。同时,RECIST沿用了WHO标准对疗效的评价办法,但在详细定义上有所不同[7]。
RECIST简化了丈量步骤,有利于重复丈量,降落了人为偏差的涌现概率,但仍未完备办理实体瘤评价中存在的问题。首先,RECIST仅在肿瘤形态为近球形时丈量较为简便及准确;其次,需丈量的目标病灶数量依旧过多,增加了丈量事情量。同时,短缺对肿瘤干系淋巴结的描述[8]。此种情形下,数年后便更新了RECIST。
RECIST 1.1发布于2009年,是对RECIST的更新。在RECIST根本年夜将淋巴结的影像学表现纳入评价范畴,定义CT扫描淋巴结短径≥15 mm为有病理意义的可丈量目标病灶,每次丈量应在相同的解剖平面;短径≥10 mm且<15 mm的淋巴结称为有病理意义的不可丈量非目标病灶。针对所需丈量目标病灶数量过多的问题,通过对欧洲癌症治疗研究组织实体瘤临床试验数据库的6 500例患者18 000多处目标病灶的丈量及比拟研究,在对评估应答率(完备缓解和部分缓解所占比例)和无进展生存期无影响的情形下,决定将可丈量目标病灶从最多10个减为5个,每个器官从最多5个减为2个[9]。同时,推举18F-氟代脱氧葡萄糖PET/CT作为确定进展的赞助手段[10,11]。末了,强调评估为完备缓解时应确保所有淋巴结为非病理性淋巴结。明确疾病进展不仅哀求目标病灶长径总和比例增加20%,实际增加长度还应≥5 mm。
上述各标准均将实体瘤疗效评估限定于肿瘤大小的改变,而肿瘤内部坏去世对肿瘤的治疗效果有着不可忽略的影响[12],临床上须要一种将肿瘤坏去世纳入个中的新评估标准。
三、改良实体瘤临床疗效评价标准(modified response evaluation criteria in solid tumor, mRECIST)
2010年美国肝脏疾病研究协会将非手术治疗后肿瘤体积未变或增大,但内部涌现坏去世的评估方法纳入到RECIST标准中,形成了mRECIST。mRECIST采取全新的单径丈量法(丈量径线时,应避开肿瘤动脉期未强化部分),以治疗前后肿瘤最大径的变革反响其对治疗的敏感性[13]。mRECIST建议选择边缘清晰、动脉期强化明显的病灶作为目标病灶。先前接管过局部或全身治疗的肝细胞癌病灶若显示出清晰的活性肿瘤区域(动脉期比拟增强),且最大径≥1 cm,也可作为目标病灶。而边界不清,不适宜准确、重复丈量的浸润型肝细胞癌应视为非目标病灶。mRECIST认为门静脉癌栓很难进行同等性评价,故视为不可丈量病灶。同时认为肝门处淋巴结短轴≥20 mm时为恶性淋巴结[13]。关于疗效的描述,mRECIST认为非目标病灶内动脉期强化消逝,应评价为非目标病灶完备缓解,若持续存在动脉期强化应评价为不完备缓解或疾病稳定。新病灶的涌现和/或现有非目标病灶的明确进展表明疾病进展[14]。mRECIST对付新发病灶的定义更加详细:最大径≥1 cm且结节在动态成像上显示出肝细胞癌的范例血管模式。mRECIST标准对完备缓解、部分缓解、疾病稳定和疾病进展分别做出了新的定义[8,15]。
在mRECIST中加强了影像学的浸染,可以明确区分活性肿瘤与坏去世肿瘤,更加准确地评估病情,使一些过早被评估为失落去治疗机会的患者重新得到治疗机会。但由于肝细胞癌不须要病理诊断便可确诊,且大部分肝细胞癌与肝硬化共存,而mRECIST仅能评价具有范例影像学特色的肝细胞癌病灶,故运用该标准有忽略非范例肝细胞癌病灶的可能性[8]。
四、欧洲肝病学会(European Association for the Study of the Liver, EASL)标准
EASL标准是在WHO标准的根本上提出,两者丈量办法及评价标准同等,但EASL标准将肿瘤内部涌现坏去世的评估纳入个中。EASL标准推举利用增强CT或增强MRI的影像学结果作为一线评估的依据,通过丈量肿瘤的强化范围判断治疗效果。规定当丈量结节<1 cm时,应在4个月内进行超声复查。若超声检讨的滋扰较多(如肥胖、肠道气体等)时,可考虑行CT或MRI等影像学检讨。同时,EASL标准不推举利用甲胎蛋白,由于甲胎蛋白对早期肝细胞癌常规监测的本钱效益不理想[16]。2018年,EASL标准更新,其重点是将肝脏特异性造影剂增强MRI纳入肝细胞癌的一线诊断,同时建议利用超声造影作为富血供肝细胞癌的二线诊断方法[17]。EASL标准认为应丈量所有可丈量病灶以明确治疗效果。但有学者分别运用EASL标准与mRECIST评估相同研究工具,比拟丈量不同目标病灶数目对评估效果的影响,结果显示两种标准得到的整体肿瘤负荷基本同等、影像学评估结论和预测生存期也无明显差异。解释EASL标准过多地丈量病灶增加了事情量与人工偏差的风险,却对结果无明显影响[18]。
五、肝癌疗效评价标准(response evaluation criteria in cancer of the liver, RECICL)
上述各标准均以肿瘤的全身治疗为根本,而大多数肝细胞癌需联合局部治疗。针对该情形,日本学者于1994年发布了RECICL初版,随后多次更新[19,20]。个中2004版RECICL明确指出其紧张用于评估射频溶解和经导管肝动脉化疗栓塞等局部治疗肝内目标病灶的效果。2010版、2015版RECICL逐步将分子靶向治疗纳入干系评价标准。2015年修订版要点包括:(1)将目标病灶的纳入数量调度至与RECIST 1.1同等,强调若肝内病灶较多,根据米兰标准,最多选取3个病灶作为目标病灶;(2)将肿瘤面积扩大50%作为新的疾病进展标准;(3)明确规定不同治疗所对应的评估韶光;(4)对付局部区域治疗或经导管肝动脉化疗栓塞后涌现的新病变,评估为疾病进展后,应标明新病变与先前治疗区域的关系,以备后续回顾剖析用[11,21]。
2019年RECICL再次修订,要点包括:(1)给出了整体评估的详细方法,即将长轴的长度乘以与长轴垂直的最大径,打算出单个目标病灶的面积,所有目标病灶的面积之和作为基线面积。非手术治疗后面积的打算方法与其类似,用长轴的长度乘以所有已坏去世或缩小的目标病灶与长轴垂直的最大径,并将其相加;(2)认为将肝内新发病灶阐明为疾病进展并不总是恰当的。在肿瘤的全身治疗阶段,由于药物浸染的整体性,新病灶涌现即表明当前治疗无效。而局部治疗时,涌现新病灶并不虞味着治疗无效,可能为肝癌的多中央病变或肝内转移或复发,是局部治疗未浸染到该区域的结果。因此,涌现新的肝内病灶不一定须要改变治疗方案,而是须要评估该病灶涌现的区域与原治疗区域的关系;(3)将肿瘤的治疗效果分为4个等级,并以此为依据定义了完备缓解、部分缓解、疾病稳定和疾病进展(表1)[19]。
2021版RECICL紧张修订纳入mRECIST作为肝细胞癌全身治疗疗效的评价标准[20],虽然两者均将肿瘤的坏去世纳入评估,但RECICL中对肝细胞癌专属特色的考虑,使其在评估肝细胞癌治疗时具有其他标准所不具备的上风[19,20]。
六、免疫治疗时期干系标准
随着免疫治疗在肿瘤治疗中的广泛运用,传统实体瘤评价体系无法对免疫治疗中涌现的假性进展、超进展与分离反应等做出准确评价[22,23,24,25]。为精确评估疗效,及时识别获益患者,制订了数个免疫治疗干系评价标准,并不断更新和完善。
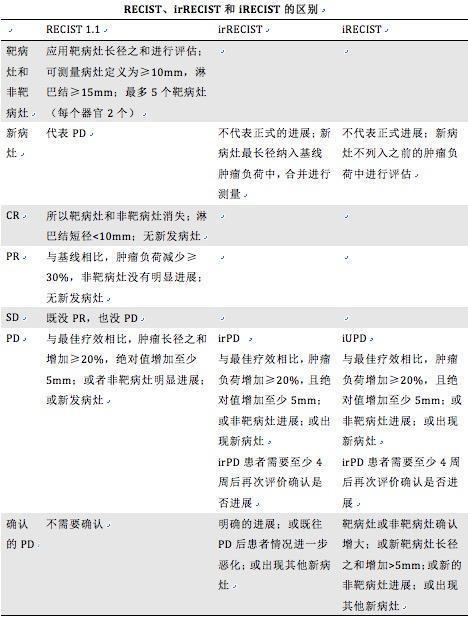
1.免疫干系反应标准(immune-related response criteria, irRC)是2009年基于WHO标准提出的免疫治疗评价标准。以病灶最大垂直径乘积的总和量化肿瘤负荷,称为肿瘤总负荷。规定了目标病灶的数目,每个器官最多5个病灶,统共最多10个内脏病灶,5个陵犯皮肤的病灶[24,26]。将治疗效果分为免疫干系的完备缓解、免疫干系的部分缓解、免疫干系的疾病稳定、免疫干系的疾病进展(表1)。明确在随访韶光内涌现新的不可丈量病灶不能定义为进展,只能打消免疫干系的完备缓解[27]。irRC的涌现使肿瘤的免疫治疗有了专属的评估标准。但其纳入的肿瘤丈量数目较多,加之沿用了WHO标准的二维丈量法,增加了丈量韶光及偏差概率。同时,irRC也未明确提出运用何种影像学评估办法[28]。
2.实体瘤免疫干系疗效评价标准(immune-related response evaluation criteria in solid tumor, irRECIST)发布于2013年,基于RECIST 1.1制订,目的是更好地评估抗肿瘤治疗效果并减少irRC中的歧义。irRECIST对病灶的定义及成像办法的选择与RECIST 1.1类似,规定非结节可丈量病灶的最大径与结节可丈量病灶的短轴共同组成总丈量肿瘤负荷。与RECIST 1.1不同,irRECIST认为涌现新的病变并不虞味着疾病进展,应将其按纳入标准分类,丈量总肿瘤负荷后,再依据irRECIST评价为免疫干系的完备缓解、免疫干系的部分缓解、免疫干系的疾病稳定、免疫干系的疾病进展[29],个中对付疾病进展要在第一次评估为免疫干系的疾病进展后至少4周再次评估,创造较初次评估进展或有新病灶才可认定[28]。
3.实体瘤免疫治疗疗效评价标准(immuno-response evaluation criteria in solid tumor, iRECIST):iRECIST发布于2017年,紧张针对免疫治疗中因免疫细胞浸润而导致影像学上肿瘤体积增大的情形,提出假性进展的观点,并提出与之对应的评价标准:免疫未确定疾病进展与免疫确定疾病进展[24]。iRECIST对目标病灶的定义及丈量与RECIST 1.1同等。RECIST 1.1评价为疾病进展,在没有确定为免疫确定疾病进展时,若患者病情稳定,则应连续治疗并于4~8周后再次评价,若符合免疫完备缓解、免疫部分缓解或免疫疾病稳定,则评为相应等级;若证明目标病灶增加≥5 mm、新非目标病灶有任何增加则评价为免疫确定疾病进展,进展韶光应从首次创造病灶进展时打算;若评价结果与先前评价同等,则应连续原治疗方案并再次评价[30]。iRECIST的涌现,办理了免疫治疗中面对症状稳定的疑似进展期患者是否须要改换治疗方案问题。
综上,不同肝细胞癌非手术治疗评价标准各有优点及不敷之处,有学者认为约8.3%经免疫治疗的肝细胞癌患者运用RECIST 1.1评价导致评价效果低于实际效果[31]。irRECIST等评价标准紧张是为这8.3%的患者供应精确的疗效评价,使其得到连续接管免疫治疗的机会。而实体瘤的诊疗参考依据,RECIST 1.1与mRECIST仍是首选,在此根本上,也应考虑结合其他评价标准,为患者供应更加精准的评估和治疗。
七、展望
近年来随着科学技能的发展,一些借助于新兴技能的疗效评价标准也逐步产生。上述标准能在二维层面评估病灶的变革,存在不同层面评估结果截然不同的可能,以是构建三维体积的评估标准应运而生。美国约翰·霍普金斯医院的Geschwind教授团队在mRECIST和EASL标准根本上,运用增强MRI三维定量的方法,提出了肝癌活性病灶体积丈量的RECIST和定量EASL标准[32]。近年来,有研究表明肿瘤学中的标准成像18F-氟代脱氧葡萄糖PET/CT可作为评估肿瘤侵袭性和预后的有效方法,影响临床医师治疗决策[33]。除此之外,肿瘤标志物也是肝细胞癌治疗效果评估的一个主要组成部分,例如利用非常凝血酶原联合甲胎蛋白评价肝癌经导管肝动脉化疗栓塞治疗效果[34],但尚未形成完全的评价体系。总之,技能的进步推动着肝细胞癌治疗评价标准的发展,合理利用各种评价标准,将会给肝细胞癌患者带来更加精准的评估和治疗。
参考文献
[1]
SungH, FerlayJ, SiegelRL, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3):209-249. DOI: 10.3322/caac.21660.
[2]
LlovetJM, MontalR, VillanuevaA. Randomized trials and endpoints in advanced HCC: role of PFS as a surrogate of survival[J]. J Hepatol, 2019, 70(6):1262-1277. DOI: 10.1016/j.jhep.2019.01.028.
[3]
MillerAB, HoogstratenB, StaquetM, et al. Reporting results of cancer treatment[J]. Cancer, 1981, 47(1):207-214. DOI: 3.0.co;2-6\"大众 xlink:type=\"大众simple\"大众>10.1002/1097-0142(19810101)47:1<207::aid-cncr2820470134>3.0.co;2-6.
[4]
ParkJO, LeeSI, SongSY, et al. Measuring response in solid tumors: comparison of RECIST and WHO response criteria[J]. Jpn J Clin Oncol, 2003, 33(10):533-537. DOI: 10.1093/jjco/hyg093.
[5]
TherasseP, ArbuckSG, EisenhauerEA, et al. New guidelines to evaluate the response to treatment in solid tumors. European Organization for Research and Treatment of Cancer, National Cancer Institute of the United States, National Cancer Institute of Canada[J]. J Natl Cancer Inst, 2000, 92(3):205-216. DOI: 10.1093/jnci/92.3.205.
[6]
LalchandaniUR, SahaiV, HersbergerK, et al. A radiologist's guide to Response Evaluation Criteria in Solid Tumors[J]. Curr Probl Diagn Radiol, 2019, 48(6):576-585. DOI: 10.1067/j.cpradiol.2018.07.016.
[7]
KusabaH, SaijoN. A summary report of response evaluation criteria in solid tumors (RECIST criteria)[J]. Gan To Kagaku Ryoho, 2000, 27(1):1-5.
[8]
林康强,喻亚群. 实体肿瘤治疗疗效评估系统的发展及其在肝癌靶向治疗中的运用现状[J]. 中国普通外科杂志,2022, 31(7):958-965. DOI: 10.7659/j.issn.1005-6947.2022.07.013.
[9]
EisenhauerEA, TherasseP, BogaertsJ, et al. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1)[J]. Eur J Cancer, 2009, 45(2):228-247. DOI: 10.1016/j.ejca.2008.10.026.
[10]
GrimaldiS, TerroirM, CaramellaC. Advances in oncological treatment: limitations of RECIST 1.1 criteria[J]. Q J Nucl Med Mol Imaging, 2018, 62(2):129-139. DOI: 10.23736/S1824-4785.17.03038-2.
[11]
TovoliF, RenzulliM, GranitoA, et al. Radiologic criteria of response to systemic treatments for hepatocellular carcinoma[J]. Hepat Oncol, 2017, 4(4):129-137. DOI: 10.2217/hep-2017-0018.
[12]
靳宏虎,赵长应,张桢,等. 两种实体瘤疗效评价标准对肝细胞癌患者系统化疗效果评价的比较[J]. 中华肝胆外科杂志,2019, 25(6):411-414. DOI: 10.3760/cma.j.issn.1007-8118.2019.06.003.
[13]
LencioniR, LlovetJM. Modified RECIST (mRECIST) assessment for hepatocellular carcinoma[J]. Semin Liver Dis, 2010, 30(1):52-60. DOI: 10.1055/s-0030-1247132.
[14]
段秀苹,黄子星. 肝癌局部治疗后的影像学评估 [J]. 中国普外根本与临床杂志,2022, 29(1): 93-99. DOI: 10.7507/1007-9424.202111064.
[15]
LlovetJM, LencioniR. mRECIST for HCC: performance and novel refinements[J]. J Hepatol, 2020, 72(2):288-306. DOI: 10.1016/j.jhep.2019.09.026.
[16]
KimTH, KimSY, TangA, et al. Comparison of international guidelines for noninvasive diagnosis of hepatocellular carcinoma: 2018 update[J]. Clin Mol Hepatol, 2019, 25(3):245-263. DOI: 10.3350/cmh.2018.0090.
[17]
KimTH, YoonJH, LeeJM. Emerging role of hepatobiliary magnetic resonance contrast media and contrast-enhanced ultrasound for noninvasive diagnosis of hepatocellular carcinoma: emphasis on recent updates in major guidelines[J]. Korean J Radiol, 2019, 20(6):863-879. DOI: 10.3348/kjr.2018.0450.
[18]
KimBK, KimSU, KimMJ, et al. Number of target lesions for EASL and modified RECIST to predict survivals in hepatocellular carcinoma treated with chemoembolization[J]. Clin Cancer Res, 2013, 19(6):1503-1511. DOI: 10.1158/1078-0432.CCR-12-2721.
[19]
KudoM, IkedaM, UeshimaK, et al. Response Evaluation Criteria in Cancer of the Liver version 5 (RECICL 2019 revised version)[J]. Hepatol Res, 2019, 49(9):981-989. DOI: 10.1111/hepr.13394.
[20]
KudoM, IkedaM, UeshimaK, et al. Response Evaluation Criteria in Cancer of the liver version 6 (Response Evaluation Criteria in Cancer of the Liver 2021 revised version)[J]. Hepatol Res, 2022, 52(4):329-336. DOI: 10.1111/hepr.13746.
[21]
KudoM, UeshimaK, KuboS, et al. Response Evaluation Criteria in Cancer of the Liver (RECICL) (2015 Revised version)[J]. Hepatol Res, 2016, 46(1):3-9. DOI: 10.1111/hepr.12542.
[22]
韩帅,谷小磊,李晓婷,等. 肝细胞癌免疫/靶向治疗中肿瘤评效标准比较[J]. 中国医学影像学杂志,2021, 29(10):1022-1027,1034. DOI: 10.3969/j.issn.1005-5185.2021.10.014.
[23]
彭诗云. 肝癌靶向治疗的功能影像学评价现状[J]. 中国医学影像学杂志,2017, 25(2):151-154. DOI: 10.3969/j.issn.1005-5185.2017.02.020.
[24]
JiaW, GaoQ, HanA, et al. The potential mechanism, recognition and clinical significance of tumor pseudoprogression after immunotherapy[J]. Cancer Biol Med, 2019, 16(4):655-670. DOI: 10.20892/j.issn.2095-3941.2019.0144.
[25]
HumbertO, ChardinD. Dissociated response in metastatic cancer: an atypical pattern brought into the spotlight with immunotherapy[J]. Front Oncol, 2020, 10:566297. DOI: 10.3389/fonc.2020.566297.
[26]
WolchokJD, HoosA, O'DayS, et al. Guidelines for the evaluation of immune therapy activity in solid tumors: immune-related response criteria[J]. Clin Cancer Res, 2009, 15(23):7412-7420. DOI: 10.1158/1078-0432.CCR-09-1624.
[27]
InnoA, Lo RussoG, SalgarelloM, et al. The evolving landscape of criteria for evaluating tumor response in the era of cancer immunotherapy: from Karnofsky to iRECIST[J]. Tumori, 2018, 104(2):88-95. DOI: 10.1177/0300891618766173.
[28]
CarterBW, BhosalePR, YangWT. Immunotherapy and the role of imaging[J]. Cancer, 2018, 124(14):2906-2922. DOI: 10.1002/cncr.31349.
[29]
CalandriM, SolitroF, AngelinoV, et al. The role of radiology in the evaluation of the immunotherapy efficacy[J]. J Thorac Dis, 2018, 10(Suppl 13):S1438-S1446. DOI: 10.21037/jtd.2018.05.130.
[30]
PersigehlT, LennartzS, SchwartzLH. iRECIST: how to do it[J]. Cancer Imaging, 2020, 20(1):2. DOI: 10.1186/s40644-019-0281-x.
[31]
ManitzJ, D'AngeloSP, ApoloAB, et al. Comparison of tumor assessments using RECIST 1.1 and irRECIST, and association with overall survival[J]. J Immunother Cancer, 2022, 10(2):e003302. DOI: 10.1136/jitc-2021-003302.
[32]
LinM, PellerinO, BhagatN, et al. Quantitative and volumetric European Association for the Study of the Liver and Response Evaluation Criteria in Solid Tumors measurements: feasibility of a semiautomated software method to assess tumor response after transcatheter arterial chemoembolization[J]. J Vasc Interv Radiol, 2012, 23(12):1629-1637. DOI: 10.1016/j.jvir.2012.08.028.
[33]
KornbergA, FriessH. 18F-fludeoxyglucose positron emission tomography for diagnosis of HCC: implications for therapeutic strategy in curative and non-curative approaches[J]. Therap Adv Gastroenterol, 2019, 12:1756284819836205. DOI: 10.1177/1756284819836205.
[34]
查俊豪,陆建,郭金和. 非常凝血酶原联合甲胎蛋白评价原发性肝癌TACE治疗代价[J]. 参与放射学杂志,2019, 28(6):591-594. DOI: 10.3969/j.issn.1008-794X.2019.06.020.
干系阅读
肝细胞癌免疫联合治疗多学科中国专家共识(2023版)
作者:国际肝胆胰协会中国分会, 中华医学会外科学分会肝脏外科学组, 中国临床肿瘤学会(CSCO)肝癌专家委员会
文章来源:中华消化外科杂志, 2023, 22(3)
▲ 点击阅读
肝细胞肝癌的新赞助治疗
作者:曹洪祥, 黄平
文章来源:国际外科学杂志, 2022, 49(12)
▲ 点击阅读
肝细胞癌转化和新赞助治疗的进展与寻衅
作者:曾永毅, 林孔英, 陈寂静
文章来源:中华消化外科杂志, 2023, 22(2)
▲ 点击阅读
平台互助联系办法
电话:010-51322382
邮箱:cmasurgery@163.com
欢迎关注普外空间微信矩阵
普外空间订阅号
普外空间CLUB做事号
普外空间视频号
普外空间小助手










