盘点ADC药物NSCLC治疗领域中的最新研究进展。
近年来,随着机制的创新和技能日益成熟,ADC药物发展迅猛,成为热点探索方向,并在肺癌领域展现出令人鼓舞的治疗前景。ADC药物将精准与强效完美结合在一起,通过发挥特异性靶向浸染、高效杀伤肿瘤细胞并且抗体部分可介导抗肿瘤免疫效应,精准摧毁肿瘤细胞。不久前结束的2024 ASCO年会中公布了多种ADC药物在非小细胞肺癌(NSCLC)治疗领域的最新成果,为NSCLC治疗领域供应了新的治疗思路。值此契机,医学界肿瘤频道特邀浙江省肿瘤医院范云教授对ADC药物在NSCLC治疗领域中的研究进展进行盘点,并针对干系研究意义进行深入解读,为NSCLC治疗供应主要参考。ADC药物在NSCLC免疫/靶向耐药后的研究新进展

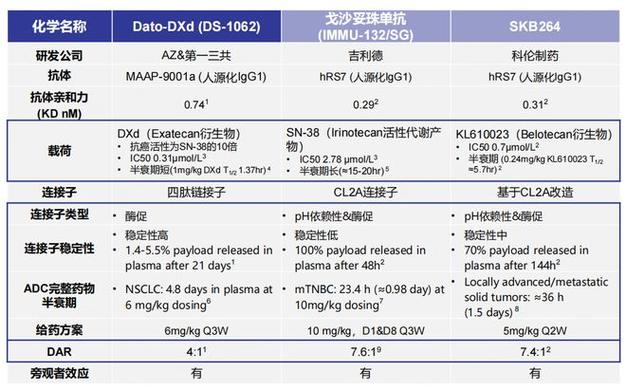
靶向治疗、免疫检讨点抑制剂治疗是目前晚期NSCLC患者的一线标准疗法[1],但耐药问题仍旧不可避免。晚期NSCLC后线治疗多采取PD-1抑制剂或化疗进行治疗,但CheckMate-057、KEYNOTE-010、RATIONALE-303、OAK等浩瀚研究均证明[2-5]对免疫/靶向耐药的晚期NSCLC患者无论是利用PD-1抑制剂还是化疗,获益均不持久,中位无进展生存期(PFS,2.3-4.2个月),客不雅观缓解率(ORR,14%-23%)仍有待进一步提高。此外对付一线免疫/靶向治疗耐药后晚期NSCLC的治疗,许多临床试验正在探索中,但浩瀚试验均以失落败告终。因此,对付一线免疫/靶向治疗耐药后的NSCLC人群,亟需探索新型治疗方案。ADC药物的涌现或可为这一类患者带来新的治疗选择,个中TROP2 ADC药物在免疫/靶向治疗耐药NSCLC治疗领域研究进展最快。 TROP2靶向ADC在晚期NSCLC领域中的研究进展TROP2是一种细胞表面糖蛋白,在肿瘤细胞自我更新、增殖、入侵和转化中发挥着重要浸染,且在多种肿瘤中高表达[6]。在NSCLC患者中,高达64%的腺癌细胞、75%的鳞癌细胞中可不雅观察到TROP2高表达,并且与NSCLC不良预后(较高去世亡率、较差的TNM分期等)直接干系[7,8]。目前TROP2已经成为肺癌领域ADC药物研发的主要靶点,诸如Dato-DXd、戈沙妥珠单抗、SKB264等TROP2靶向ADC药物走在了该赛道的前列。Dato-DXd、戈沙妥珠单抗、SKB264虽同为TROP2靶向ADC药物,但在药物构造上存在一定差异,这些差异可能造就了它们抗肿瘤活性和安全性方面的差异。2024 ASCO年会Dato-DXd首次公布中国NSCLC人群数据,这次表露数据来自TROPION-Pantumor02研究[9]。这是一项多中央、开放标签、多行列步队的I/II期研究,NSCLC行列步队入组的患者是:既往接管含铂化疗和免疫治疗(不伴可靶向基因组改变(AGAs))或既往接管靶向治疗和含铂化疗(伴AGAs)。研究共纳入40例NSCLC患者,个中23例患者为非鳞癌;所有患者既往均接管过含铂化疗,大部分(92.5%)患者接管过免疫治疗。截止2023年10月9日,中位随访韶光为8.1个月,在NSCLC行列步队总人群中,独立的中心审查(ICR)评估的ORR为45.0%(95%CI 29.3-61.5),中位PFS为7.4个月。个中非鳞癌患者展现出更显优的生存获益,ICR评估的ORR为56.5%(95%CI 34.5-76.8),中位PFS为9.6个月。同时,在安全性方面,NSCLC行列步队并未不雅观察到新的安全旗子暗记,未宣布药物干系间质性肺病(ILD),临床总体可控可耐受。这次表露的中国经治NSCLC患者的数据提示,Dato-DXd在中国晚期经治NSCLC患者中的疗效与安全性和TROPION-Lung01研究同等,且非鳞癌患者获益更大。图1. TROPION-Pantumor02研究数据TROPION-Lung01研究,是目前首个且唯一ADC药物在肺癌领域取得紧张研究终点阳性结果的III期注册研究。既往研究结果显示,Dato-DXd单药给经治NSCLC患者带来了无进展生存期(PFS)具有统计学意义的显著改进,且非鳞状细胞癌亚组中不雅观察到更优的中位PFS获益[10]。2024欧洲肺癌大会(ELCC)更新了TROPION-Lung01研究的非鳞癌亚组数据[11]。截止2023年3月29日,Dato-DXd组较多西他赛组中位PFS延长近2个月(5.5个月 vs 3.6个月,HR=0.63;95%CI 0.51-0.79),降落疾病进展或去世亡风险37%;Dato-DXd组的ORR是多西他赛组的近3倍,个中疗效评估达完备缓解(CR)的患者有4例(2%),达部分缓解(PR)的患者69例(30%);Dato-DXd组肿瘤应答持续韶光较多西他赛组长2.1个月(7.7个月 vs. 5.6个月)。在所有NSQ NSCLC人群的预设亚组中,Dato-DXd均显示出同等PFS获益趋势,个中AGA亚组获益程度最大(HR=0.35)。安全性方面,Dato-DXd组≥3级TRAEs发生率低于多西他赛组,分别为22%和41%。比较多西他赛,Dato-DXd大幅减少血液学毒性发生率,中性粒细胞减少发生率仅4%,≥3级的发生率不到1%。整体来看,Dato-DXd安全性良好,安全性事宜与既往宣布同等,常见的TRAEs为口腔炎、恶心和脱发。基于这一研究成果,Dato-DXd的生物制品容许申请(BLA)已经于2024年2月19日得到美国FDA受理,或将成为首个获批肺癌适应症的TROP2 ADC。本次ASCO大会公布EVOKE-01研究的结果[12]。研究共纳入603例晚期NSCLC患者,个中戈沙妥珠单抗(SG)组纳入299例患者,多西他赛组纳入304例患者;两组所有患者均接管过化疗和抗PD-(L)1治疗。截止于2023年11月29日,SG组与多西他赛组的中位总生存期(OS)分别为11.1个月和9.8个月(HR=0.84,p=0.0534),OS并未达到统计学显著意义,12月OS率SG组更高(46.6% vs 36.7%)。安全性方面,SG组的≥3级TEAEs和导致停药的AEs发生率低于多西他赛组,最常见≥3级TEAE为中性粒细胞减少,发生率为25%。TROP2是ADC的靶点,由于其在肿瘤组织中高表达,但目前还没有明确证据表明可以选择其作为TROP2 ADC治疗肿瘤患者的生物标志物,因此预测性生物标志物研究是未来TROP2 ADC探索方向之一。同时不良反应的管理以及TROP2 ADC与其他药物的联合治疗也都是未来TROP2 ADC探索的方向。ICARUS-Lung01研究是一项多中央、单臂的II期研究,旨在评估Dato-DXd(6 mg/kg IV Q3W)在晚期经治NSCLC患者中的疗效、安全性,同时探索与疗效/耐药性干系的生物标志物。本次ASCO大会上公布其研究结果[13]。研究结果初步显示,能从Dato-DXd单药中获益的TROP2表达范围广。图3. ICARUS-Lung01研究生物标记剖析中PFS与TROP2表达之间的关系2024 ASCO年会表露3个TROP2 ADC与免疫联合用于1L NSCLC治疗的研究结果,数据显示TROP2 ADC和免疫联用的方案在1L NSCLC患者中展现出抗肿瘤活性。TROPION-Lung02研究是一项环球性、开放性、剂量递增和扩展研究,旨在评估Dato-DXd联合帕博利珠单抗±铂类在晚期无已知驱动基因改变NSCLC患者中的初步安全性和疗效。统共评估6个行列步队,扩展行列步队紧张纳入初治患者。本次ASCO大会上更新了该研究的数据[14]。一线共有96名患者分别接管了双药治疗(n=42)和三药治疗(n=54)。根据这次公布数据显示,无论PD-L1表达水平,双药和三药组均可不雅观察到相应,ORR分别为52%和56%,疾病掌握率(DCR)分别为88%和89%,中位DoR分别为NE和12.9个月,中位PFS分别为11.1个月和6.8个月。在安全性方面,双药组和三药组患者涌现的任何等级TEAEs的发生率未见显著差异。最常见的TEAE为口腔炎(多为1~2级)、恶心、血虚、便秘和食欲减退。图4. TROPION-Lung02研究的疗效数据EVOKE-02研究[15]中行列步队A的研究结果显示,行列步队A(n=30)的ORR为66.7%,中位PFS为13.1个月。安全性方面,行列步队A中≥3级TEAEs发生率为66.7%,最常见的≥3级TEAE为中性粒细胞减少。图5. EVOKE-02研究行列步队A的疗效及安全性数据OptiTROP-Lung01研究[16]的研究结果显示,SKB264联合PD-L1抑制剂,Q2W组疗效更优,ORR为77.6%,中位PFS未达到。在安全性方面,与SKB264单药已知安全性同等。图6. OptiTROP-Lung01研究的疗效及安全性数据HER2突变NSCLC约占总体NSCLC的2%-4%[17],既往患者一线治疗进展后可选办法以化疗为主,疗效有限(ORR 10%,mPFS 4.3个月),并且伴随着严重的不良反应。因此,急迫须要探索新型治疗策略。DESTINY-Lung02研究是一项多中央、随机双盲、剂量优化、非对照临床研究,旨在评估德曲妥珠单抗(T-DXd)(5.4mg/kg和6.4mg/kg)用于经治HER2突变不可切除或转移性NSCLC患者的疗效和安全性。本次ASCO大会公布该研究的终极剖析结果[18]。终极剖析结果显示,截止2023年8月25日,经BICR评估的ORR为50.0%,中位DoR为12.6个月,中位PFS为10.0个月,中位OS为19.0个月。此外,无论HER2基因突变类型、既往接管过治疗的线数和种类如何,5.4 mg/kg的德曲妥珠单抗在治疗HER2突变转移性NSCLC方面,均展现出强大的疗效,并且安全性上是可管可控的。DESTINY-Lung05研究为DESTINY-Lung02研究的中国桥接研究[19],目的是评估德曲妥珠单抗在至少接管过一线治疗后疾病进展的HER2突变中国转移性非鳞状NSCLC患者中的疗效和安全性。2024年AACR公布该研究结果。结果显示,中位随访韶光为9.8个月,经ICR评估的ORR为58.3%,中位PFS尚未达到,12个月PFS率为55.1%。图7. DESTINY-Lung02和05研究的疗效数据凭借DESTINY-Lung系列研究的显著疗效,德曲妥珠单抗于2022年8月得到了美国FDA批准用于既往接管过系统治疗的HER2突变晚期NSCLC患者的治疗,成为了首个获批适用于HER2突变NSCLC的靶向药物。目前,包括NCCN、CSCO指南均将德曲妥珠单抗作为HER2突变晚期NSCLC患者后线治疗的标准推举方案[20-22],且2024年CSCO指南将德曲妥珠单抗的推举等级从III级推举提升至II级推举。《Lancet Oncology》公布了II期DESTINY-Lung01研究过表达行列步队数据[23],从2018年8月至2020年1月,共49例患者纳入行列步队1,41例患者纳入行列步队1A,研究结果显示,两组经ICR评估确认的ORR分别为26.5%和34.1%,个中行列步队1中13例患者均为PR,行列步队1A中2例CR及12例PR;两组DCR分别为69.4%和78.0%;两组中位PFS分别为5.7个月和6.7个月;两组中位OS分别为12.4个月和11.2个月。总之,HER2突变在NSCLC中较为罕见,患者面临的治疗选择有限,紧张依赖化疗,疗效和安全性均不理想。德曲妥珠单抗作为一种HER2靶向ADC药物,在DESTINY-Lung02和05研究中显示出对HER2突变NSCLC的显著疗效和可控的安全性,已成为FDA批准的首个适用于此类患者的ADC药物,并受到国内外威信指南的推举。其他HER2 ADC还须要进一步进行探索,进一步确定其抗肿瘤活性。临床II期LUMINOSITY研究已初步证明Telisotuzumab Vedotin单药治疗c-MET过表达EGFR野生型NSCLC的疗效[24],c-MET高表达患者中ORR为34.6%,mOS为14.6个月。III期研究TeliMET NSCLC-01将进一步探索Telisotuzumab Vedotin对付c-MET过表达、EGFR野生型、既往经治的局晚期/转移性非鳞状NSCLC患者的疗效[25]。KisMET-01是一项多中央、首次人体研究,探索MYTX-011治疗既往经治局部晚期或转移性NSCLC患者,结果显示药代动力学表现稳定,并且安全性良好[26]。MRG004A是一种TF靶点特异性偶联的新型ADC药物,2024年ASCO年会上报告了MRG004A治疗晚期实体瘤患者的I/II期研究的安全性及初步疗效结果[27]。除上述药物之外,还有多个类型ADC药物在NSCLC或实体瘤领域中进行探索。表2. 多个其他类型ADC在NSCLC或实体瘤中进行的研究(非头敌人研究,无法进行直接比拟)随着研究的深入,针对晚期NSCLC的治疗策略正逐步扩展。靶向治疗或免疫治疗耐药后的治疗选择有限,疗效不佳且不良反应严重,使得新型治疗策略的探索显得尤为急迫。ADC药物有望为靶向、免疫治疗耐药的患者供应一种全新的治疗策略。浩瀚研究数据显示了TROP2 ADC在晚期经治NSCLC中的疗效,个中Dato-DXd有望成为肺癌邻域首个获批的TROP2 ADC,TROP2 ADC联合免疫的治疗方案也显示出良好的抗肿瘤活性,有望为患者供应新的治疗选择。德曲妥珠单抗作为HER2 ADC也为HER2变异晚期NSCLC患者带来良好获益。展望未来,随着更多ADC药物的研发和运用,NSCLC患者的治疗选择将更加多样化。同时,对ADC药物浸染机制的深入研究将有助于我们更好地理解其疗效和安全性,为临床运用供应更加科学的辅导。期待在不久的将来,这些新型药物能够为NSCLC患者带来更好的治疗效果和生活质量。浙江省肿瘤医院胸部肿瘤内科主任,内科规培基地主任
中国临床肿瘤学会(CSCO)常务理事
中国临床肿瘤学会小细胞肺癌专家委员会副主任委员
中国医师协会肿瘤多学科诊疗专委会常委
中国抗癌协会肺癌专业委员会委员
浙江省抗癌协会肿瘤内科专业委员会主任委员
浙江省医师协会肿瘤精准治疗专委员会主任委员
浙江省医学会肿瘤学分会副主任委员
参考文献:
[2]Borghaei H, Paz-Ares L, Horn L, et al. Nivolumab versus Docetaxel in Advanced Nonsquamous Non-Small-Cell Lung Cancer. N Engl J Med. 2015 Oct 22;373(17):1627-39.[3]Herbst RS, Garon EB, Kim DW, et al. Five Year Survival Update From KEYNOTE-010: Pembrolizumab Versus Docetaxel for Previously Treated, Programmed Death-Ligand 1-Positive Advanced NSCLC. J Thorac Oncol. 2021 Oct;16(10):1718-1732.[4]Zhou C, Huang D, Fan Y, et al. Tislelizumab Versus Docetaxel in Patients With Previously Treated Advanced NSCLC (RATIONALE-303): A Phase 3, Open-Label, Randomized Controlled Trial. J Thorac Oncol. 2023 Jan;18(1):93-105.[5]Rittmeyer A, Barlesi F, Waterkamp D, et al. Atezolizumab versus docetaxel in patients with previously treated non-small-cell lung cancer (OAK): a phase 3, open-label, multicentre randomised controlled trial. Lancet. 2017 Jan 21;389(10066):255-265.[6]Seligson JM, Patron AM, Berger MJ, et al. Sacituzumab Govitecan-hziy: An Antibody-Drug Conjugate for the Treatment of Refractory, Metastatic, Triple-Negative Breast Cancer. Ann Pharmacother. 2021 Jul;55(7):921-931.[7]Mito R, Matsubara E, Komohara Y, et al. Clinical impact of TROP2 in non-small lung cancers and its correlation with abnormal p53 nuclear accumulation. Pathol Int. 2020 May;70(5):287-294.[8]Inamura K, Yokouchi Y, Kobayashi M, et al. Association of tumor TROP2 expression with prognosis varies among lung cancer subtypes. Oncotarget. 2017 Apr 25;8(17):28725-28735.[9]Sun Y, Cheng Y, Li J, et al. Datopotamab deruxtecan (Dato-DXd) in Chinese patients (pts) with advanced or metastatic non-small cell lung cancer (NSCLC): Results from the phase 1/2 TROPION-PanTumor02 study.2024 ASCO. Abstract 8548.[10]Ahn M , Lisberg A, Paz-Ares L, et al.Datopotamab deruxtecan (Dato-DXd) vs docetaxel in previously treated advanced/metastatic (adv/met) non-small cell lung cancer (NSCLC): results of the randomized phase 3 study TROPION-Lung01. 2023 ESMO. LBA12.[11]Girard N, Okamoto I, Lisberg A, et al. Datopotamab Deruxtecan (Dato-DXd) in Patients with Previously Treated Advanced Non-Small Cell Lung Cancer (NSCLC) - Nonsquamous (NSQ) Histology in the Phase 3 TROPION-Lung01 Tria.2024 ELCC. 59P.[12]Paz-Ares L, Juan-Vidal O, Mountzios G, et al. Sacituzumab govitecan (SG) vs docetaxel (doc) in patients (pts) with metastatic non-small cell lung cancer (mNSCLC) previously treated with platinum (PT)-based chemotherapy (chemo) and PD(L)-1inhibitors (IO): Primary results from the phase 3 EVOKE-01 study. 2024 ASCO. LBA8500.[13]Planchard D, Cozic N, Wislez M, et al. ICARUS-LUNG01: A phase 2 study of datopotomab deruxtecan (Dato-DXd) in patients with previously treated advanced non-small cell lung cancer (NSCLC), with sequential tissue biopsies and biomarkers analysis to predict treatment outcome. 2024 ASCO. Abstract 8501.[14]Levy B, Paz-Ares L, Su W, et al. Datopotamab deruxtecan (Dato-DXd) plus pembrolizumab (pembro) with or without platinum chemotherapy (Pt-CT) as first-line (1L) therapy for advanced non-small cell lung cancer (aNSCLC): Subgroup analysis from TROPION-Lung02. 2024 ASCO. Abstract 8617.[15]Patel J, Cho B, Cobo M, et al. Sacituzumabgovitecan (SG) + pembrolizumab (pembro) infirst-line (1L) metastatic non-small cell lung cancer (mNSCLC) with PD-L1 ≥ 50%: Cohort A of EVOKE-02. 2024 ASCO. Abstract 8592.[16]W Fang, Wang Q, Chen Y, et al. Sacituzumab Tirumotecan (芦康沙妥珠单抗; Also Known as SKB264/MK-2870) in Combination With KL-A167 (Anti‒PD-L1) as First-Line Treatment for Patients With Advanced NSCLC From the Phase II OptiTROP-Lung01 Study. ASCO 2024. Abstract 8502.[17]Mar N, Vredenburgh JJ, Wasser JS. Targeting HER2 in the treatment of non-small cell lung cancer. Lung Cancer. 2015 Mar;87(3):220-5.[18]Janne P, Goto Y, Kubo T, et al. Trastuzumab deruxtecan (T-DXd) in patients with HER2-mutant metastatic non–small cell lung cancer (mNSCLC): Final analysis results of DESTINY-Lung02. 2024 ASCO. Abstract 8543.[19]Cheng Y, Lin W, Yong F, et al. Trastuzumab deruxtecan (T-DXd) in Chinese patients (pts) with previously treated HER2 mutant non-small cell lung cancer (NSCLC): primary analysis from the Phase 2 DESTINY-Lung05 (DL-05) trial.2024 AACR. CT248.[20]中国临床肿瘤学会(CSCO)非小细胞肺癌诊疗指南(2024年)[21]NCCN Clinical Practice Guidelines in Oncology:Non-Small Cell Lung Cancer(Version 7.2024)[22]Chinese expert consensus on the diagnosis and treatment of HER2-altered non-small cell lung cancer. Thorac Cancer. 2023 Jan;14(1):91-104.[23]Smit EF, Felip E, Uprety D, et al. Trastuzumab deruxtecan in patients with metastatic non-small-cell lung cancer (DESTINY-Lung01): primary results of the HER2-overexpressing cohorts from a single-arm, phase 2 trial. Lancet Oncol. 2024;25(4):439-454.[24]Camidge D, Bar J, Horinouchi H, et al. Telisotuzumab vedotin monotherapy in patients with previously treated c-Met–overexpressing non-squamous EGFR wildtype advanced NSCLC: Primary analysis of the LUMINOSITY trial. 2024 ASCO. Abstract 103.[25]Lu S, Goldman J, Tanizaki J, et al. A phase 3 global study of telisotuzumab vedotin versus docetaxel in previously treated patients with c-Met 0verexpressing, EGFR wildtype, locally advanced/metastatic nonsquamous NSCLC (TeliMET NSCLC-01). 2024 ASCO. Abstract TPS8656.[26]Johnson M, Burns T, Thompson J, et al. MYTX-011 in patients with previously treated locally advanced or metastatic NSCLC: Initial dose escalation results in the phase 1 KisMET-01 study. 2024 ASCO. Abstract 8558.[27]Park W, Zhang J, Dayyani F, et al. Phase I/II first-in-human study to evaluate the safety and efficacy of tissue factor-ADC MRG004A in patients with solid tumors. 2024 ASCO. Abstract 3002. 此文仅用于向医学人士供应科学信息,不代表本平台不雅观点